6 pasos para tratar la cetoacidosis diabética en niños y evitar el edema cerebral.
Paso 1: Realiza el diagnóstico con los siguientes criterios:
Glucosa > 200 mg/dL
pH > 7.30
Cetonemia mayor de 0.3 mMol/l o Cetonuria > 80 mg/dL
Cuadro clínico: deshidratación, polidipsia, poliuria, polifagia, respiración de Kussmaul, deterior neurológico variable, dolor abdominal.
Paso 2: Establece la severidad del cuadro clínico:
pH < 7.3 o HCO3< 15 : leve
pH < 7.2 o HCO3 < 10: moderada
pH < 7.1 o HCO3 < 5: severa
Paso 3: inicia aporte de líquidos en carga y calcula requerimientos hídricos:
Paciente en estado de choque (Glasgow bajo < 13), taquicardia, llenado capilar > 3 segundos, pulsos periféricos filiformes, no esperar a encontrar hipotensión):
Una sola carga de solución salina al 0.9% a 10 mL kg: verifica que mejore la FC, los pulsos periféricos y el llenado capilar disminuye. Administrar en 10 – 15 minutos. Valorar una segunda carga de acuerdo a datos de perfusión.
Paciente con deshidratación leve o moderada: No requiere cargas, repito, no requiere cargas (esta sugerencia está referida en las Guías NICE Baja la guía aquí.
Requerimientos hídricos se calculan con regla de 4-2-1
Por los primeros 10 Kg a 4 mL kg hora
Por los siguientes 11 – 20 Kg se suma 2 mL kg hora
Por los siguientes Kg arriba de 20 1 mL kg hora
Ejemplo: Basales para niña de 30 Kg:
10 kg x 4 mL = 40 mL +
10 kg x 2 mL = 20 mL +
10 kg x 1 mL = 10 mL
Total 70 mL/hora
Los líquidos de mantenimiento en CAD son 1.5 los basales, no mas de eso.
1.5 x 70 mL h = 105 mL/h
Paciente con normonatremia: Inicialmente se coloca una bolsa de solución salina al 0.9% con velocidad de infusión a 105 mL/hora.
Paciente con hipernatremia (sodio corregido > 145 mEq/L): Colocar una bolsa de agua bidestilada de 1 litro y una más de salina al 0.9%, ambas administrar a 52.5 mL/hora (la solución resultante tendrá una concentración al 0.45% de cloruro de sodio).
Paso 4: inicia insulina en infusión:
Coloca 50 UI de insulina de acción rápida aforadas a 50 mL con ABD
Administra a 0.1 mL kg h hora = 0.1 UI kg hora
La insulina se inicia una vez que se terminó el bolo de cristaloide o se recuperó al paciente del estado de choque, usualmente una hora después de que inició manejo.
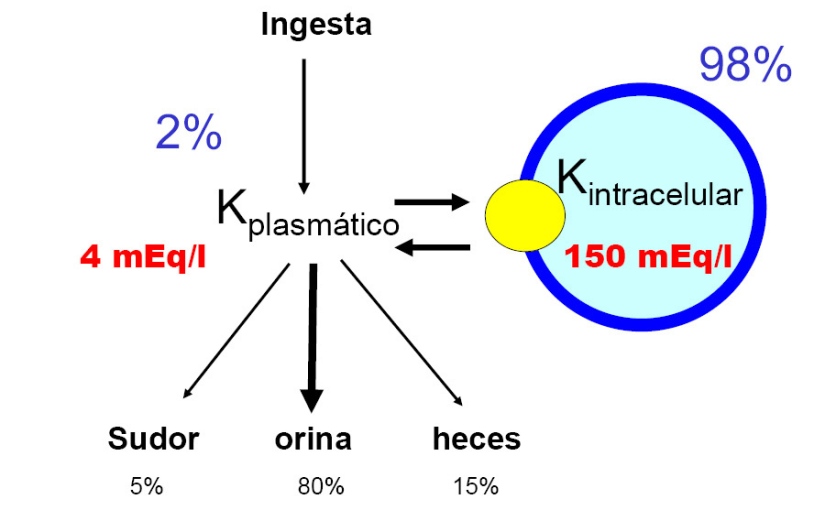
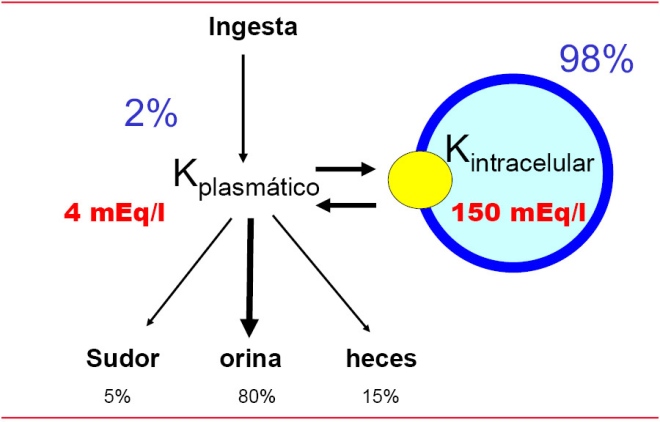
Paso 5: manejo del potasio:
Potasio sérico < 4 mEq/L: iniciar a 60 mEq/L, 50% de acetato de potasio y 50% cloruro de potasio.
Potasio sérico 4 – 5.4 mEq/L: 40 mEq/L, 50% de acetato de potasio y 50% de cloruro de potasio.
Potasio sérico 5.5 – 6 mEq/L: No administrar potasio
Potasio sérico > 6 mEq/L: No administrar potasio.
Monitorizar niveles séricos cada 2 horas.
Administrar fosfato de potasio cuando fosfato sérico sea < 2 mg/dL.
Paso 6: manejo de la glucosa IV:
Cuando la glucosa sérica sea menor de 300 mg/dL inicia G5% 1:1 con técnica de doble bolsa.
Una bolsa de solución salina al 0.9% de 1 litro y una más de glucosa al 10%, se administran a la misma velocidad de infusión para cubrir los requerimientos de mantenimiento calculados. Para el ejemplo de un paciente de 30 Kg la velocidad de infusión de cada bolsa será de 52.5 mL/hora.
El objetivo es disminuir la glucosa entre 50 – 100 mg/dL por hora y subir el pH a 7.30, bicarbonato a 15 mEq/L y evitar el edema cerebral.
Si la glucosa disminuye más de 100 mg/dL, aumentar la concentración de glucosa al 12.5%. Mantener infusión hasta revertir la acidosis metabólica.
Otras recomendaciones:
1. Evitar rehidratación aguda innecesaria, bolos de bicarbonato y de insulina: aumentan el riesgo de edema cerebral.
2. Evitar intubar al paciente, la respiración de Kussmaul revertirá una vez que la acidosis metabólica mejore.
3. Mantener la infusión de solución con glucosa aunque haya «rebote» de la hiperglicemia al iniciarla, pero JAMÁS suspenda la infusión de glucosa. No desespere, el paciente se estabilizara con este tratamiento.
3. En cuanto el paciente pueda beber, darle agua. Restar del aporte IV lo que ingiera de agua.
4. Iniciar esquema subcutáneo y dieta una vez conseguidos los objetivos de tratamiento de la CAD.
Bibliografía:
Megan Elizabeth Lavoie, MD. Management of a Patient With Diabetic Ketoacidosis in the Emergency Department. Pediatric Emergency Care. Volume 31, Number 5, May 2015
Guías NICE Diabetes (type 1 and type 2) in children and young people: diagnosis and management. 2015





.png)
Debe estar conectado para enviar un comentario.