Todo paciente grave debe ser monitorizado con la finalidad de que las decisiones tomadas sobre su tratamiento sean las más adecuadas. Nunca se debe tomar las evaluaciones con cálculos hemodinámicas como parámetros ÚNICO en la toma de decisiones del paciente pediátrico grave.
Solo los datos obtenidos a través de termodilución, Lidcco, Picco, etc ofrecen datos fidedignos de la hemodinamia de los pacientes.
Sin embargo, a forma de ejercicio, sobre todo para aquellos médicos que se encuentran en formación es útil realizar estas valoraciones a la cama del paciente pediátrico crítico, complementando la evaluación hemodinámica del mismo.
PARAMETROS DE OXIGENACION
CONTENIDOS ARTERIALES DE OXIGENO VENOSO Y ARTERIAL
CaO2 (contenido arterial de oxígeno) = (Hb x SaO2 x 1.31) + (0.0031 x paO2)
Normal: 16 – 20 ml/dL
CvO2 (contenido venoso de oxígeno)= (Hb x SvO2 x 1.31) + (0.0031 x pvO2)
Normal: 12 – 16 ml/dL
Recordemos que la sangre transporta el oxígeno de dos formas: unido a la hemoglobina y disuelto en sangre. La mayor proporción de oxígeno trasportada es mediante su unión a la hemoglobina por lo que la pO2 solo representa una fracción muy pequeña del oxígeno arterial y nunca debe de tomarse como parámetro único que nos determine si un paciente está bien o mal oxigenado.
Para su cálculo solo debemos tener dos gasometrías una arterial y una venosa y en caso de sustitución de la saturación esta debe expresarse en decimales. La gasometría venosa siempre debe ser de catéter central o de vena cava superior o vena cava inferior.
La causa principal de que los contenidos estén disminuidos es la anemia, seguido de la hipoxemia.
DIFERENCIA ARTERIO – VENOSA DE OXIGENO
D a – v (diferencia arterial- venosa de oxígeno)= CaO2 – CvO2
Normal: 2– 5 ml/dL
Para su cálculo se debe restar el contenido venoso de oxígeno al contenido arterial de oxígeno.
Si se encuentra por debajo de 2 se asocia a hiperdinamia, el paciente esta rubicundo con o sin hipotensión arterial, con taquicardia y polipnea, llenado capilar en flash, raramente esta con oliguria, de inicio, aunque si este estado persiste, inciará la hipotensión arterial, con taquicardia, oliguria, hiperlactatemia y gasto cardíaco elevado buscando mantener la perfusión de órganos vitales. La hiperdinamia es un estado en el cual el aumento del gasto cardiaco y disminución de las resistencias vasculares sistémicas permiten acortar la diferencia arterio – venosa y mantener en límites elevados la reserva venosa de oxígeno, con saturación de vena cava superior o de catéter central por arriba del 70%.
Si la diferencia arterio venosa se encuentra por arriba de 5 la asociamos a un estado hipodinámico, donde el paciente generalmente se encuentra con piel fría, marmórea, hipotenso, oligúrico, llenado capilar generalmente de más de 5 segundos, hiperlactaemia, falla orgánica múltiple. Es el estado asociado al síndrome de bajo gasto cardíaco clásico.
Este estado se asocia a una caída del gasto cardiaco con resistencias vasculares sistémicas aumentadas. La saturación venosa central o de vena cava superior es inferior de 70%.
GASTO CARDIACO
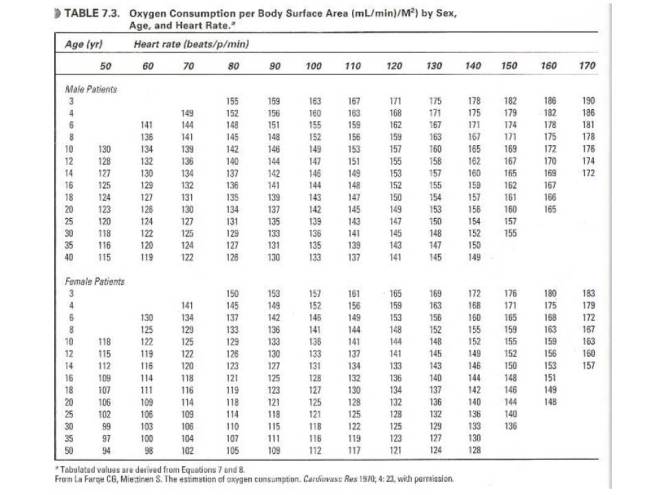
No existe una fórmula 100% confiable para calcular el gasto cardiaco por métodos aritméticos, pero podemos inferirlo mediante un cálculo conociendo el consumo de oxígeno. Extraído del libro de Anestesia Cardiaca de Carol Lake colocamos como anexo al documento. El estudio no incluyo casos menores de 3 años. Para obtener el VO2 primero determinamos si es hombre o mujer y después la edad que se acerque más a la de nuestro paciente y la cruzamos con la frecuencia cardíaca que tenga en el momento de tomar las gasometrías arterial y venosa que se debe tomar al mismo tiempo en un espacio no mayor a 2 minutos.
GC (gasto cardiaco)= VO 2/ (D a –v*10)
Normal: 3.5 – 5 L min
Los neonatos tienen gasto cardiaco menores al litro minuto debido a su bajo peso corporal.
CONSUMO DE OXIGENO
La cantidad de oxígeno consumida por minuto por metro cuadrado de superficie corporal.
VO2 (consumo de oxígeno)= GC x (d a – v)
También se puede inferir con la siguiente tabla 7.3
El consumo de oxígeno se encuentra elevado en la sepsis, quemados, SDRA, y cualquier patología grave.
No depende de la disponibilidad de oxígeno siempre y cuando la disponibilidad no se encuentre en un grado crítico menor de 500 mL min m2sc.
VOLUMEN SISTOLICO
VS (Volumen sistólico) = (GC x 1000)/Frecuencia cardiaca
Normal: 60 – 90 mL por latido
Es la cantidad de sangre eyectada por el corazón por latido. Disminuirá si la función de contractilidad cardiaca se ve afectada.
INDICE DE VOLUMEN SISTOLICO
IVS (Índice de volumen sistólico)= volumen sistólico/superficie corporal
Normal: 30 – 60 ml latido m2
Es la relación que existe entre el volumen sistólico y la superficie corporal.
INDICE CARDIACO
IC (índice cardiaco) = GC/SC (superficie corporal)
Mantener entre 3.2 y 6 L/min/m2 en pacientes sépticos
Normal: 2.8 – 4.2 L/min/m2
Es la relación que existe entre el gasto cardiaco y la superficie corporal.
DISPONIBILDAD DE OXIGENO
Es la cantidad de oxigeno expresado en L por minuto que está contenida en sangre arterial por metro cuadrado de superficie corporal.
DO2 (disponibilidad de oxígeno) = IC x CaO2 x 10
Normal = 500 – 700 mL min m2
Esta disponibilidad se ve severamente afectada por la hipoxemia y la anemia.
EXTRACCION DE OXIGENO
EO2 (Extracción de oxígeno)= (VO2/DO2) x 100
Normal: 15 – 30%
S la relación que existe entre el consumo de oxígeno y la disponibilidad del mismo. Usualmente está entre 15 – 30%. Si la extracción de oxígeno se encuentra menor del 15% es posible que el niño se encuentre en hiperdinamia. Si la extracción se oxígeno es mayor del 30% es posible que el paciente se encuentre en hipodinamia.
RESISTENCIAS SISTEMICAS Y PULMONARES
Representan la fuerza que se opone al flujo sanguíneo a través de los vasos sanguíneos sistémicos y pulmonares.
Se encuentran en relación indirecta con el gasto cardiaco. Si el gasto cardiaco aumenta las RVS e encontraran disminuidas así como también las pulmonares. Si el gasto cardiaco disminuye las RVS y RVP se encontraran aumentadas con la finalidad de preservar el flujo sanguíneo en órganos vitales: corazón, cerebro y glándulas suprarrenales.
RVS (resistencias vasculares sistémicas)= (PAM (presión arterial media) – PVC (Presión venosa central) x 79.9/GC)
Normal: 1200 – 1500 dinas segundo cm -5
Para obtener los valores requerimos conocer la PVC y la PAM así como la Presión arterial media de la arteria pulmonar y al presión en cuña o presión capilar pulmonar para el cálculo de las resistencias vasculares pulmonares.
RVP (Resistencias vasculares pulmonares)= (Presión media de arteria pulmonar – presión de enclavamiento pulmonar (o presión de atrio izquierdo)) x 79.9/gasto cardiaco
Normal: 100 – 300 dinas segundo cm -5
EJEMPLO
Niña de tres años de edad con choque séptico. Frecuencia cardiaca de 120 por minuto, PAM de 75 mmHg, PVC 12 mmHg. Para esta niña según la tabla de valores de VO2 le corresponde por su edad y sexo 165 mL min m2sc de VO2. La hemoglobina de encuentra en 11.2 mg/dL.
Gasometría arterial con pO2 de 91, SaO2: 95%, gasometría venosa con po2 de 48 y una SvO2 de 80%. Superficie corporal de 0.8
Calculando los contenidos arterial y venoso de oxígeno:
CaO2= (11.2 mg/dL* 0.95*1.31mL/dL) + (0.0031*91) = 14.1mL de oxígeno por 100mL de sangre arterial.
CvO2= (11.2mg/dL*0.80*1.31mL/dL) + (0.0031*48) =11.8 mL de oxígeno por 100mL de sangre venosa
D a-v = 14.1 – 11.8 = 2.3
Calculando el Gasto cardiaco: 165 mL min m2sc de VO2/ (10*2.3) =7.1 L/min
Índice cardiaco: 7.1L /min/(0.8 m2sc) = 8.8 L/min
Disponibilidad de oxígeno (DO2)= 8.8L minm2sc*10*14.1 (CaO2) =1240mL min m2sc
Extracción de oxígeno = (165 mL min m2sc de VO2/1240 mL min m2sc de DO2) *100 = 13%
Volumen sistólico = 7100 mL min (GC en litros min) / 120 FC =59 mL
Índice de volumen sistólico = 59 mL latido /SC de 0.8 =73 mL latido por m2sc
Resistencias vasculares sistémicas = ((PAM de 75 – PVC de 12)*79.9)/GC de 7.1L/min =708 dinas segundo cm -5
Conclusión la D av esta acortada pero no es menor de 2 el GC está elevado y las resistencias sistémicas normales, el paciente presenta una tendencia a un estado hiperdinámico. Estos datos obtenidos por este método nunca deberán considerarse de forma aislada para tomar decisiones en un paciente crítico, solo son parte de una evaluación complementaria, las decisiones finales deberán ser acompañadas por una exploración física extensa apoyados por datos gasométricos, variables hemodinámica y por un extensivos análisis clínico de cada caso en particular.
Bibliografía.
- R. Phillip Dellinger, MD. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2012. CCM journal. February 2013 • Volume 41 • Number 2
- Dellinger RP, Levy MM, Rhodes A, et al: Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock: Pediatric considerations. 2012. Crit Care Med. 2013; 41:580-637
- Joe Brierley, MD. Clinical practice parameters for hemodynamic support of Pediatric and neonatal septic shock: 2007 update from the American College of Critical Care Medicine. Crit Care Med 2009 Vol. 37, No. 2
- Alonso Salas MT, de Carlos Vicente Juan Carlos, Gil Antón J, Pinto Fuentes I d, Quintilla Martinez JM, Sánchez Díaz J. Documento de consenso SECIP-SEUP sobre manejo de sepsis grave y Shock séptico en pediatría.
- Stephen Playfor MBBS DCH MRCP MRCPCH MD. Management of the critically ill child with sepsis. Continuing Education in Anaesthesia, Critical Care & Pain | Volume 4 Number 1 2004
- Levy M, Fink M, Marshall J,et al.2001 SCCM/ESICM/ACCP/ ATS/SIScInternational Sepsis Definitions Conference. Intensive Care Med 2003; 29: 530-8.
- Goldstein B; Giroir B; Randolph A; Members of the International ConsensuscConference on Pediatric Sepsis. International Pediatric sepsis consensuscconference: Definitions for sepsis and organ dysfunction in pediatrics. Pediatr CritcCare Med 2005;6: 2-8.
- Carcillo JA, Fields AI. American College of Critical Care Medicine Task Force Committee Members. Clinical practice parameters for hemodynamic support of pediatric and neonatal patients in septic shock. Crit Care Med 2002;30:1365-78.
- Robinson DT, Kumar P, Cadichon SB. Neonatal Sepsis in the Emergency Department. Clin Ped Emerg Med 2008;9:160-68.
- Dieckmann RA. Pediatric Assessment. En: Gausche-Hill M, Fuchs S, Yamamot L. American Academy of Pediatrics, American College of Emergency Physicians. APLS: The Pediatric Emergency Resource. Sudbury (USA): Jones and Bartlett Publishers, 2004, págs. 20-51.
- Carol L. Lake, Peter D. Booker. Lippincott Williams & Wilkins, 2005
- David Gregory Nichols, Mark Charles RogersRogers’ Textbook of Pediatric Intensive Care. Wolters Kluwer Health/Lippincott Williams & Wilkins










.png)

Debe estar conectado para enviar un comentario.