El siguiente es un resumen del capítulo de asma grave en UCIP del libro de cuidados intensivos pediátricos de Zimermman en quinta edición, la última. Espero que les guste y puedan compartirlo.
Tratamiento farmacológico del asma grave pediátrico en la Unidad de Cuidados Intensivos.
General
Los pacientes con asma crítico que ingresan en la UCI representan un grupo heterogéneo, que requiere diferentes niveles de monitoreo y tratamiento. Sin embargo, todos los pacientes que están lo suficientemente enfermos como para justificar el ingreso en la UCI deben ser monitoreados mediante el rastreo continuo de ECG, la frecuencia respiratoria continua, la presión arterial no invasiva y la SO2. Los pacientes más enfermos que requieren muestras de sangre frecuentes se beneficiarán de un catéter arterial permanente. Los pacientes con insuficiencia respiratoria que requieren ventilación mecánica deben tener un acceso venoso central confiable y adecuado.
Oxígeno
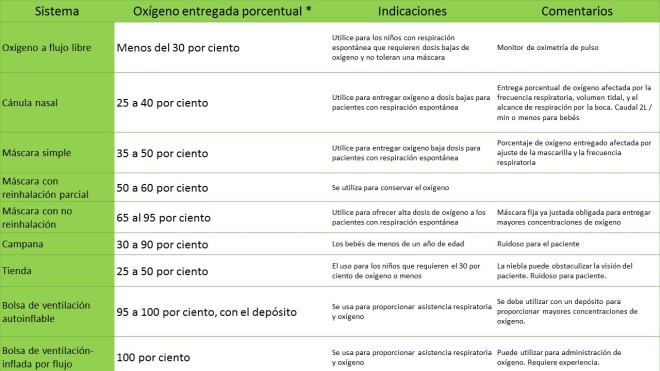
Los pacientes con exacerbaciones de asma más graves presentan universalmente hipoxemia como resultado de derivaciones intrapulmonares causadas por taponamiento mucoso, atelectasia e hiperinflación. El tratamiento con agentes β-agonistas también contribuye a la hipoxemia al suprimir la vasoconstricción hipóxica pulmonar regional y al aumentar la derivación intrapulmonar. Los pacientes pueden tener hipoxemia a pesar de una radiografía de tórax de apariencia normal, ya que la hiperinflación regional puede resultar en la conversión de segmentos pulmonares de la zona de West 2 a la zona de West 1, lo que aumenta el desajuste de ventilación-perfusión. Por lo tanto, se debe usar oxígeno humidificado para la nebulización y continuamente entre tratamientos. El oxígeno suplementario puede incorporarse de manera segura en el algoritmo de tratamiento, porque a diferencia de algunos pacientes adultos con enfermedad pulmonar obstructiva crónica grave o asma, no existe evidencia que sugiera que el oxígeno suplementario suprima el impulso respiratorio en niños con asma crítico.
Fluidos
Los pacientes con asma grave suelen presentar una disminución del agua corporal total debido a la disminución de la ingesta de líquidos por vía oral y al aumento de las pérdidas de agua insensible. Por lo tanto, la mayoría de los pacientes requieren algún grado de expansión de volumen. Esto debe equilibrarse cuidadosamente con la necesidad de evitar la sobrehidratación debido a la propensión a la migración del fluido transcapilar y la inundación alveolar que presentan algunos pacientes con grandes oscilaciones en las presiones intratorácicas. La necesidad de una rápida expansión del fluido a menudo se hace evidente poco después de la intubación de pacientes con bajos volúmenes intravasculares que reciben agentes β-agonistas. Los pacientes deben permanecer en ayuno y en líquidos intravenosos isotónicos hasta que una mejora en el estado respiratorio permita el inicio seguro de la nutrición enteral.
Corticosteroides
Los corticosteroides desempeñan un papel central en el tratamiento de pacientes con asma crítico y casi fatal, considerando que estas afecciones son de naturaleza predominantemente inflamatoria. Los agentes glucocorticosteroides modulan la inflamación de las vías respiratorias mediante una serie de mecanismos, incluida la interacción directa con los receptores citosólicos y los elementos de respuesta a los glucocorticosteroides en los promotores de los genes y los efectos indirectos sobre la unión de factores de transcripción, como el factor nuclear-κB, y en otros procesos de señalización celular, como los eventos de postranscripción. Los productos genéticos suprimidos por los agentes glucocorticosteroides incluyen una amplia gama de citoquinas (IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-11, IL -12, IL-13, factor de necrosis tumoral-α y factor estimulante de colonias de granulocitos-macrófagos), moléculas de adhesión (molécula de adhesión intracelular-1 y molécula de adhesión de células vasculares-1) y enzimas inducibles, incluidas la NO sintetasa y la ciclooxigenasa. La transcripción de otros genes, como la lipocortina-1 y el receptor β2 – adrenérgico, puede mejorarse. Los agentes glucocorticosteroides también disminuyen la producción de moco en las vías respiratorias, reducen la infiltración y activación de las células inflamatorias y atenúan la permeabilidad capilar.
En niños con asma crítico o casi mortal, los glucocorticosteroides deben administrarse por vía intravenosa. La vía oral se puede utilizar en casos seleccionados, pero los glucocorticosteroides inhalados no desempeñan ningún papel en el tratamiento del paciente hospitalizado. El agente más común usado en los Estados Unidos es la metilprednisolona debido a su amplia disponibilidad como preparación IV y la falta de efectos mineralocorticoides. La dosis habitual de metilprednisolona es de 0,5 a 1 mg / kg / dosis, administrada por vía intravenosa cada 6 horas. La hidrocortisona, un agente con actividad tanto glucocorticoide como mineralocorticoide, puede usarse como una alternativa en dosis de 2 a 4 mg / kg / dosis, administrada por vía intravenosa cada 6 horas. Cursos cortos de esteroides por lo general son bien tolerados sin efectos adversos significativos. Sin embargo, la hipertensión, la hiperglucemia, los trastornos del estado de ánimo y las infecciones virales graves, como la varicela mortal, se han notificado en pacientes con asma que se habían administrado glucocorticosteroides. La duración de la terapia con corticosteroides está determinada por la gravedad de la enfermedad y la respuesta clínica, pero la inflamación de las vías respiratorias continúa mucho después de que mejoran los síntomas clínicos. Una vez iniciado, el tratamiento con corticosteroides sistémicos se continúa durante 5 a 7 días y es seguido por esteroides inhalados a largo plazo. Los tratamientos más prolongados requieren el destete gradual del fármaco para disminuir las posibilidades de insuficiencia suprarrenal sintomática o recaída. Debe considerarse la profilaxis con un bloqueador H 2 o un inhibidor de la bomba de protones debido a la posibilidad de gastritis asociada con esteroides y perforación gástrica.
β-agonistas
Las propiedades β-agonistas de los agentes simpaticomiméticos causan la relajación del músculo liso bronquial y, por lo tanto, la broncodilatación. Estos agentes también pueden aumentar la contractilidad diafragmática, mejorar el aclaramiento mucociliar e inhibir los mediadores broncospásticos de los mastocitos. Por lo tanto, los β-agonistas, junto con los corticosteroides sistémicos, son el pilar de la farmacoterapia en personas con asma crítica y casi mortal. La selectividad del receptor β 2 es deseable para evitar los efectos adversos de la estimulación no selectiva del receptor α y β 1 adrenérgico. Sin embargo, a pesar de la relativa selectividad β 2, los efectos adversos cardiovasculares siguen siendo un factor limitante de la dosis. La potencia relativa de varios agentes para el receptor β 2 es la siguiente: isoproterenol> fenoterol> albuterol> terbutalina> isoetharina> metaproterenol. De estos, solo el albuterol y la terbutalina se usan ampliamente en la práctica clínica, y algunos centros siguen usando isoproterenol en ocasiones seleccionadas.
Una vez unidos al receptor β-adrenérgico, los β-agonistas activan la adenil ciclasa, lo que resulta en un aumento de los niveles de monofosfato de adenosina cíclica intracelular (AMPc), lo que conduce a la relajación del músculo liso bronquial y vascular. Las curvas de dosis-respuesta demuestran que los grandes aumentos de dosis no mejoran significativamente la broncodilatación. Sin embargo, a medida que aumenta el grado de constricción bronquial, la curva de dosis-respuesta broncodilatadora se desplaza hacia la derecha, lo que indica la necesidad de una dosis más alta para lograr la respuesta deseada.
En las personas con asma casi mortal, las vías de administración parenteral y en aerosol se utilizan exclusivamente. La terapia tradicional para personas con asma crítica incluyó anteriormente dosis subcutáneas de epinefrina, pero la epinefrina ya no se usa ampliamente debido al desarrollo de agentes β-agonistas más nuevos y selectivos con una duración de acción más prolongada y menos efectos adversos.
Los efectos adversos más frecuentes de los agentes β-agonistas son el temblor del músculo esquelético, las náuseas y la taquicardia. Estos efectos adversos son comunes a los fármacos agonistas β 2 no selectivos y selectivos administrados por vía intravenosa o por vía inhalada. Otros efectos adversos cardiovasculares incluyen inestabilidad de la presión arterial (predominantemente hipotensión diastólica) y arritmias cardíacas. La isquemia miocárdica ha sido bien documentada como una complicación grave de la administración de isoproterenol por vía intravenosa (e inhalatoria) en niños con asma grave. Sin embargo, las infusiones intravenosas continuas de terbutalina generalmente son seguras y no están asociadas con una cardiotoxicidad significativa. La prolongación del intervalo QTc y la hipopotasemia se han observado durante las infusiones intravenosas de fármacos β-agonistas. La hipopotasemia se produce incluso con un potasio corporal total relativamente estable y es el resultado del desplazamiento intracelular de potasio resultante, al menos en parte, de un mayor número de bombas de sodio-potasio y no de la eliminación aumentada de potasio. Por lo tanto, la suplementación suprafisiológica de potasio rara vez es necesaria. Un efecto adverso significativo de los agentes β-agonistas es la hipoxemia. Esto se relaciona con la vasodilatación pulmonar mediada por fármacos que supera la vasoconstricción hipóxica local y el aumento de la perfusión en unidades pulmonares mal ventiladas con incremento de los shunts.
Albuterol (Salbutamol)
El albuterol es el agente de aerosol más específico para β 2 disponible en los Estados Unidos. Por lo general, se administra cada 20 minutos durante la fase inicial del tratamiento en una dosis de 0.05 a 0.15 mg / kg. La dosis y frecuencia óptimas de albuterol son variables y se ven afectadas por el volumen tidal espontáneo, el patrón de respiración, el dispositivo y la técnica. En promedio, menos del 1% del fármaco nebulizado se deposita en el pulmón. Después de la serie inicial de tres tratamientos con albuterol, debe iniciarse la nebulización continua de albuterol en pacientes que requieren tratamientos de nebulización con más frecuencia que cada hora.
La nebulización continua de albuterol parece ser superior a la administración repetida e intermitente y no causa una cardiotoxicidad significativa. Un pequeño estudio prospectivo aleatorizado en niños con asma crítica e insuficiencia respiratoria inminente indicó que los niños tratados con nebulización continua de albuterol tuvieron una mejoría clínica más rápida y hospitalizaciones más cortas que los niños tratados con dosis intermitentes de albuterol. La administración continua de albuterol también se asoció con una asignación más eficiente del tiempo de los terapeutas respiratorios y podría ofrecer la ventaja adicional de más horas de sueño ininterrumpido a los pacientes que a menudo ya están agotados. La dosis habitual de albuterol administrado de manera continua varía entre 0,15 y 0,45 mg / kg / h, con una dosis máxima de 20 mg / h. Se han usado dosis más altas de albuterol en pacientes que no responden al tratamiento estándar. Sin embargo, no apoyamos esta práctica, ya que la intensificación de los efectos adversos generalmente supera cualquier pequeña ganancia incremental en la broncodilatación. Debe recordarse que un componente importante de la obstrucción bronquial en el asma grave es el edema de la pared de las vías respiratorias y la obstrucción de la mucosidad de las vías respiratorias, ninguno de los cuales responde a los broncodilatadores.
El albuterol es una mezcla 50: 50 de R-albuterol (levalbuterol), el enantiómero activo que causa la broncodilatación, y el S-albuterol, que se creía inactivo en los humanos. El levalbuterol, el isómero R puro, está aprobado para su uso en los Estados Unidos como una solución nebulizante sin conservantes. La ventaja supuesta de levalbuterol sobre el albuterol se debe al hecho de que el S-albuterol puede no ser completamente inerte y tiene una vida media de eliminación más larga que el R-albuterol. Sin embargo, la noción de que el S-albuterol no es inerte y que es capaz de efectos adversos clínicamente significativos no se acepta universalmente. Un gran ensayo controlado aleatorio de levalbuterol versus albuterol racémico en niños con asma demostró una tasa reducida de hospitalización en pacientes tratados con levalbuterol. Sin embargo, este estudio tuvo problemas metodológicos, ya que la variable de resultado primario (tasa de ingreso al hospital) se dejó a la discreción de los médicos tratantes y ninguna de las variables de resultado secundarias fue significativamente diferente entre los grupos de tratamiento una vez que los pacientes habían sido ingresados en el hospital. . 125 Estudios clínicos aleatorizados más recientes en niños con asma no demostraron que el levalbuterol sea superior al albuterol racémico. Además, aunque el costo del levalbuterol ha disminuido significativamente, este medicamento sigue siendo más costoso que el albuterol. Teniendo en cuenta el bajo costo del albuterol y la escasez de evidencia clínica que respalde la superioridad del levalbuterol, favorecemos al albuterol como el broncodilatador de elección en niños con asma crítico y casi mortal.
El albuterol administrado por vía intravenosa no está disponible en los Estados Unidos. Sin embargo, la eficacia de las infusiones de albuterol en pacientes con asma grave ha sido bien establecida en los países donde está disponible la preparación IV.
Terbutalina
La terbutalina es un agonista β 2 relativamente selectivo con un mecanismo de acción similar al del albuterol. Es el agonista β parenteral más utilizado en los Estados Unidos y está disponible para nebulización, inyección subcutánea y uso intravenoso. Debido a su menor β 1 afinidad con los receptores, la administración subcutánea de terbutalina ha suplantado en gran medida el uso de epinefrina en personas con asma aguda grave. La terbutalina subcutánea se usa raramente en la UCIP; se reserva para pacientes con empeoramiento agudo del estado respiratorio que no tienen acceso vascular y en los que no se puede obtener fácilmente el acceso. La terbutalina subcutánea se usa más comúnmente en el tratamiento agudo de pacientes enfermos en el servicio de urgencias y antes del contacto con el hospital. La dosis habitual de terbutalina subcutánea es de 0,01 mg / kg / dosis (máximo 0,25 mg) por vía subcutánea cada 20 minutos para tres dosis, según sea necesario.
La terbutalina se usa más comúnmente en la UCI por infusión IV. Esta terapia está indicada para pacientes con asma grave que no mejoran o que muestran signos de deterioro durante el tratamiento con agonistas β 2nebulizados , bromuro de ipratropio y esteroides. El intervalo habitual de dosis de terbutalina IV es de 0,1 a 10 µg / kg / min, como una infusión continua preparada en una solución salina normal al 0,9% o D 5. W. Sin embargo, en nuestra experiencia clínica, la mayoría de los pacientes comienzan con una dosis de 1 µg / kg / min y la dosis se ajusta al efecto, con dosis superiores a 4 µg / kg / min rara vez son necesarias. A los pacientes que comienzan la terapia a dosis inferiores a 1 µg / kg / min se les puede administrar una dosis de carga de 10 µg / kg durante 10 minutos para acelerar el inicio de la acción.
Agentes anticolinérgicos
Los agentes anticolinérgicos se han convertido en una parte importante del tratamiento de los niños con asma aguda grave. El agente anticolinérgico típico utilizado en el tratamiento de pacientes con asma es el bromuro de ipratropio, un compuesto de amonio cuaternario formado por la introducción de un grupo isopropilo en el átomo de N de la atropina. A diferencia de la atropina (un compuesto de amonio terciario), el bromuro de ipratropio no cruza la barrera hematoencefálica y no causa efectos adversos anticolinérgicos centrales. Teniendo en cuenta que el tono del músculo liso bronquial está influenciado por el aporte parasimpático, el bromuro de ipratropio puede producir broncodilatación por inhibición del broncoespasmo mediado por colinérgicos. Una propiedad importante del bromuro de ipratropio es la falta de efecto negativo sobre el epitelio bronquial ciliar, a diferencia de la marcada inhibición de la pared ciliar y el aclaramiento mucociliar producido por la atropina.
El bromuro de ipratropio nebulizado (dosis de 250 a 500 µg) se puede usar cada 20 minutos durante la primera hora en el departamento de emergencias. La dosis recomendada para la terapia de continuación es de 250 a 500 µg, administrada cada 6 horas. Después de la inhalación, las respuestas máximas generalmente se desarrollan durante 30 a 90 minutos, y los efectos clínicos pueden persistir durante más de 4 horas. Los efectos sistémicos son mínimos porque menos del 1% de una dosis inhalada de bromuro de ipratropio se absorbe en la circulación. Sin embargo, se han informado efectos extrapulmonares como midriasis y visión borrosa como resultado de una absorción ocular tópica inadvertida del fármaco.
La adición de bromuro de ipratropio al albuterol nebulizado en el tratamiento del broncoespasmo tiene sentido farmacológico, porque el albuterol causa broncodilatación al aumentar los niveles de AMPc, mientras que el efecto del bromuro de ipratropio está mediado por una disminución en el monofosfato de guanosina cíclico. El uso combinado de bromuro de ipratropio y albuterol nebulizado en el tratamiento de niños con asma que acuden al servicio de urgencias ha demostrado ser rentable y reduce la tasa de ingreso en el hospital. Sin embargo, la adición rutinaria de dosis repetidas de bromuro de ipratropio nebulizado a un régimen estándar de agentes agonistas β 2 y fármacos esteroides sistémicos en niños hospitalizados con asma no parece conferir un beneficio significativo. Teniendo en cuenta el alto perfil de seguridad de los tratamientos con bromuro de ipratropio inhalado y los beneficios de su uso en el servicio de urgencias, consideramos razonable administrar bromuro de ipratropio junto con la terapia estándar para pacientes críticamente enfermos con asma a pesar de la falta de datos sólidos específicos para la población de la UCIP. .
Sulfato de magnesio
El magnesio es un antagonista fisiológico del calcio que inhibe la absorción de calcio y relaja el músculo liso bronquial. Se sabe desde la década de 1940 que el magnesio causa la broncodilatación en pacientes con asma, pero su uso como un complemento en el tratamiento de pacientes con asma grave ha ocurrido recientemente. Numerosos informes, series de casos y ensayos controlados aleatorios han sugerido una mejoría clínica cuando los pacientes asmáticos reciben infusiones intravenosas de sulfato de magnesio en el departamento de emergencias o en la UCI. Aunque hay algunas pruebas de que el magnesio es tan eficaz como el albuterol cuando se administra por nebulización y se ha utilizado con éxito como un vehículo líquido para la nebulización de albuterol, un ensayo más amplio no mostró un beneficio significativo en la estadía hospitalaria.
La indicación de sulfato de magnesio por vía intravenosa en niños con asma crítico o casi mortal aún no está clara debido a la escasez de ensayos controlados aleatorios. Algunos estudios sugieren que las infusiones de sulfato de magnesio están asociadas con mejoras significativas en la función pulmonar a corto plazo, mientras que otro estudio no mostró una mejoría en la gravedad de la enfermedad o una reducción en las tasas de hospitalización. La dosis habitual de sulfato de magnesio en niños con asma crítico o casi fatal es de 25 a 40 mg / kg / dosis, infundida por vía intravenosa, durante 20 a 30 minutos. El inicio de la respuesta clínica es rápido (ocurre en minutos) y generalmente se observa durante la infusión inicial. Se debe controlar cuidadosamente a los pacientes para detectar efectos adversos durante la infusión, que incluyen hipotensión, náuseas y enrojecimiento. La toxicidad grave, como las arritmias cardíacas, la debilidad muscular, la arreflexia y la depresión respiratoria, no es una preocupación importante con el uso de sulfato de magnesio en personas con asma aguda, cuando se usa según las indicaciones. La infusión intravenosa de sulfato de magnesio bajo condiciones controladas parece ser segura, y un subconjunto de pacientes con asma crítica y casi mortal responde claramente a esta terapia, lo que puede reducir la necesidad de soporte mecánico del ventilador. Una revisión sistemática de los ensayos controlados aleatorios publicados respalda el uso de sulfato de magnesio además de los agentes agonistas β 2 y los fármacos esteroides sistémicos en el tratamiento de personas con asma grave aguda.
Agentes Metilxantina
Los agentes de metilxantina, como su nombre lo indica, son sustancias formadas por la metilación de la xantina e incluyen cafeína, teobromina y teofilina. La solubilidad en agua de los agentes de metilxantina es muy baja, pero puede mejorarse en gran medida por la formación de complejos con una variedad de compuestos. En particular, la combinación de teofilina y etilendiamina produce aminofilina, una sal soluble en agua. Se ha desarrollado una gran cantidad de derivados de metilxantina, pero solo la teofilina y la aminofilina son relevantes para el tratamiento de pacientes con asma.
El mecanismo molecular exacto de la broncodilatación mediada por teofilina no está claro, pero se cree que implica su acción como un inhibidor de la fosfodiesterasa-4, lo que reduce la degradación del cAMP, que a su vez media las respuestas celulares que dan lugar a la relajación del músculo liso bronquial. Se han propuesto otros mecanismos de acción, incluida la inhibición de la actividad de la fosfoinositida 3-quinasa, antagonismo del receptor de adenosina, aumento de la actividad de histona desacetilasa, estimulación de la liberación de catecolamina endógena, antagonismo de la prostaglandina, y alteraciones en la movilización de calcio intracelular. La teofilina también es conocida por causar inhibición de la actividad neuronal aferente, lo que conduce a la inhibición del broncoespasmo mediado por la activación refleja de las vías colinérgicas. La teofilina tiene acciones antiinflamatorias e inmunomoduladoras y se sabe que aumenta la contractilidad diafragmática y aumenta el impulso respiratorio.
En preparaciones bronquiales humanas aisladas in vitro, concentraciones de teofilina superiores a 70 µmol / L pueden inducir una reversión del 50% de la broncoconstricción. Dichas concentraciones locales supuestamente se alcanzarían con niveles plasmáticos superiores a 10 a 20 µg / ml. Sin embargo, en la práctica clínica, este rango plantea un problema difícil debido a la estrecha ventana entre los niveles terapéuticos y la toxicidad, que a menudo se superponen. La vida media de la teofilina varía de 3 a 7 horas. Por lo tanto, la aminofilina, que es equivalente a 80% de teofilina, generalmente se administra como una infusión intravenosa continua para evitar fluctuaciones significativas en las concentraciones séricas. Cuando se toma la decisión de iniciar el tratamiento con teofilina o aminofilina, se administra una dosis de carga para alcanzar niveles séricos entre 10 y 20 µg / ml. Suponiendo un volumen de distribución promedio normal, una dosis de 1 mg / kg de teofilina (1.25 mg / kg de aminofilina) eleva la concentración sérica en 2 µg / ml. La dosis de carga debe administrarse durante 20 minutos y debe seguirse inmediatamente mediante la infusión continua del medicamento. Las dosis empíricas de aminofilina pueden iniciarse para pacientes con función hepática y cardíaca normal de la siguiente manera: lactantes menores de 6 meses: 0,5 mg / kg / h; Bebés de 6 meses a 1 año: 0. 85 a 1 mg / kg / h; Niños de 1 a 9 años: 1 mg / kg / h; y niños mayores de 9 años: 0,75 mg / kg / h. Los pacientes con función hepática o cardiovascular comprometida deben iniciarse con una dosis de 0,25 mg / kg / h. Los pacientes obesos deben tener dosis calculadas sobre el peso corporal ideal para prevenir la toxicidad. Los niveles séricos de medicamentos deben controlarse 30 a 60 minutos después de la dosis de carga y con frecuencia durante la infusión continua, considerando que las concentraciones en estado estacionario no se alcanzan hasta aproximadamente cinco semividas, lo que corresponde a 24 a 36 horas de infusión. Los pacientes obesos deben tener dosis calculadas sobre el peso corporal ideal para prevenir la toxicidad. Los niveles séricos de medicamentos deben controlarse 30 a 60 minutos después de la dosis de carga y con frecuencia durante la infusión continua, considerando que las concentraciones en estado estacionario no se alcanzan hasta aproximadamente cinco semividas, lo que corresponde a 24 a 36 horas de infusión. Los pacientes obesos deben tener dosis calculadas sobre el peso corporal ideal para prevenir la toxicidad. Los niveles séricos de medicamentos deben controlarse 30 a 60 minutos después de la dosis de carga y con frecuencia durante la infusión continua, considerando que las concentraciones en estado estacionario no se alcanzan hasta aproximadamente cinco semividas, lo que corresponde a 24 a 36 horas de infusión.
Varios estudios en adultos y niños con asma aguda indican que la terapia con teofilina o aminofilina no tiene ningún beneficio clínico. Más recientemente, los ensayos aleatorios, controlados con placebo probaron la eficacia de la aminofilina y teofilina En niños con asma crítica. El tratamiento con aminofilina produjo resultados fisiológicos significativamente mejorados, como la oxigenación y las pruebas de función pulmonar, pero no disminuyó la estadía en la UCI y se asoció con efectos adversos como náuseas y vómitos. La teofilina se asoció con una mejoría clínica más rápida, pero no tuvo efecto en la duración de la estadía de la UCIP y condujo a una frecuencia significativamente mayor de vómitos en comparación con los sujetos control. 1
Teniendo en cuenta la estrecha ventana terapéutica (10 a 20 µg / ml), que a menudo se superpone a la toxicidad (> 15 µg / ml), la evidencia cuestionable de eficacia clínica, y que los agentes de metilxantina se han asociado con efectos adversos que van desde náuseas, vómitos, y fiebre a las discinesias, convulsiones y muerte, el uso de estos agentes ha disminuido significativamente. De hecho, las metilxantinas se usaron en menos del 6% de los niños con asma crítico y casi mortal admitidos en UCI pediátricas en un estudio multicéntrico en los Estados Unidos. Teniendo en cuenta estas consideraciones, usamos agentes de metilxantina solo en pacientes seleccionados ocasionales que no responden a la terapia máxima con agentes β-agonistas, esteroides, medicamentos anticolinérgicos, sulfato de magnesio y otros complementos.
Mezclas de Helio-Oxigeno
El helio es un gas biológicamente inerte que es menos denso que cualquier otro gas, excepto el hidrógeno, y es aproximadamente una séptima parte más denso que el aire. La aplicación medicinal de helio y mezclas de oxígeno (heliox) en el tratamiento del asma y la obstrucción de las vías respiratorias extratorácicas se conoce desde hace casi 8 décadas. Debido a su baja densidad, el heliox reduce el número de Reynolds. Este efecto está asociado con una probabilidad reducida de flujo de gas turbulento al tiempo que facilita el flujo de gas laminar en las vías respiratorias, lo que disminuye el trabajo de la respiración en situaciones asociadas con una alta resistencia de las vías respiratorias. Heliox proporciona un beneficio teórico en pacientes con lesiones obstructivas de las vías respiratorias extratorácicas e intratorácicas. Varios informes abogan por el beneficio del heliox en el manejo de niños con obstrucción de las vías respiratorias extratorácicas. El papel del heliox en pacientes con asma es menos claro.
La investigación con mezclas de heliox ha demostrado un mayor porcentaje de retención de partículas pulmonares y una mayor administración de albuterol tanto de inhaladores de dosis medidas como de nebulizadores lo que sugiere que uno de los efectos beneficiosos del uso de heliox en pacientes con asma es una mejor deposición de fármacos en aerosol. Aunque existe cierta evidencia de que los tratamientos con albuterol nebulizado continúo impulsado por heliox del 70% /30% están asociados con un mayor grado de mejoría clínica en comparación con el albuterol nebulizado continuo impulsado por oxígeno en niños con exacerbaciones de asma de moderadas a severas, otros estudios no han mostrado una mejora significativa en la estadía hospitalaria o en la UCI. Cuanto más alto sea el FIO2 necesario, menos efectiva será la mezcla de heliox.
Heliox ha sido recomendado por algunos investigadores como un complemento útil en pacientes adultos con asma grave, tanto durante la respiración espontánea como durante la ventilación mecánica. Los informes anecdóticos sugieren que el heliox se asocia con una mejoría de la función pulmonar en niños con asma aguda. Sin embargo, un pequeño ensayo aleatorizado cruzado de heliox en pacientes con asma grave que respiraban espontáneamente no mostró una mejoría en la función pulmonar o en las puntuaciones de disnea. Además, una revisión sistemática de siete ensayos prospectivos y controlados en niños y adultos no apoyó el uso de heliox en pacientes con asma aguda moderada o grave. La escasez de estudios controlados, aleatorizados y bien ejecutados hace imposible evaluar el efecto terapéutico del heliox en niños con asma. Además, si el heliox es beneficioso en algunos pacientes, la duración de la administración y la mezcla óptima de helio-oxígeno siguen siendo indeterminadas. Hasta que surja más información sólida, heliox sigue siendo una terapia no probada para el asma pediátrica, y su uso debe restringirse a intentos individuales en pacientes seleccionados con asma refractaria grave o casi fatal que no responden al tratamiento convencional. Para obtener el máximo beneficio de la menor densidad del gas, deben usarse mezclas de 80: 20 o 70: 30 de helio-oxígeno, lo que limita la terapia a las personas con necesidades de oxígeno de baja inspiración.
Ketamina
El clorhidrato de ketamina es un agente anestésico disociativo con propiedades broncodilatadoras que está disponible en una solución para administración IV o intramuscular. Después de la administración intravenosa, generalmente se experimenta una sensación de disociación dentro de los 15 segundos, seguida de la inconsciencia después de otros 30 segundos. A esta reacción le sigue una analgesia profunda que dura de 40 a 60 minutos y una amnesia que puede persistir durante 2 horas. Algunos pacientes, especialmente los niños mayores, pueden experimentar una reacción de emergencia postanestesia con confusión, agitación y alucinaciones. Las dosis habituales de ketamina no afectan significativamente el impulso respiratorio hipóxico o hipercárbico. Se mantienen los reflejos faríngeos y laríngeos, y aunque el reflejo de la tos está algo deprimido, La obstrucción de la vía aérea no ocurre normalmente. Aparte de sus propiedades anestésicas, la ketamina produce sialorrea y aumenta las secreciones de las vías respiratorias, el gasto cardíaco, la frecuencia cardíaca, la presión arterial, la tasa metabólica, el flujo sanguíneo cerebral y la presión intracraneal. La resistencia vascular pulmonar no se altera y se preserva la vasoconstricción pulmonar hipóxica. La ketamina inhibe el broncoespasmo y disminuye la resistencia de las vías respiratorias, presumiblemente a través de la obstrucción de N -metil- d receptores de aspartato en el músculo liso bronquial. El efecto broncodilatador de la ketamina la convierte en un agente atractivo en pacientes con asma que requieren sedación y anestesia para la intubación o la ventilación mecánica. Sin embargo, los efectos broncodilatadores de la ketamina pueden ser contrarrestados por el aumento observado en las secreciones de las vías respiratorias y la sialorrea.
Existen preguntas con respecto al uso de ketamina en pacientes no intubados con asma grave. En el servicio de urgencias, la infusión de ketamina agregada a la terapia estándar de pacientes no intubados no ha mostrado un beneficio clínico. Sin embargo, la evidencia limitada sugiere que esta terapia puede ser útil en pacientes seleccionados al tratar de evitar la necesidad de ventilación mecánica. Según nuestra experiencia, la administración de ketamina a niños no intubados con asma grave frecuentemente precede a la necesidad de intubar y rara vez se asocia con una mejoría clínica notable. Por esta razón, los intentos de administrar ketamina a niños no intubados con asma grave siempre deben realizarse en la UCI en condiciones estrictamente controladas y con personal capaz de establecer rápidamente una vía aérea para el inicio de la asistencia ventilatoria.
La ketamina generalmente se administra como un bolo intravenoso de 2 mg / kg, seguido de una infusión continua de 1 a 2 mg / kg / h. La sialorrea resultante y el aumento de las secreciones de las vías respiratorias pueden atenuarse mediante la administración de glicopirolato o atropina. El uso simultáneo de benzodiacepinas puede atenuar la agitación y las alucinaciones en pacientes que experimentan reacciones de emergencia después de la anestesia con ketamina.






Debe estar conectado para enviar un comentario.