La ventilación mecánica en asma se reserva para pacientes con progresión continua hacia la insuficiencia respiratoria a pesar del tratamiento médico máximo.
La mejor manera de evitar la intubación es escalar rápidamente las terapias preintubación en pacientes con una trayectoria de empeoramiento indicada por el aumento del trabajo respiratorio o retención de CO2.
La ventilación mecánica en un niño con una exacerbación del asma siempre es un reto, debido a la obstrucción de las vías respiratorias, deterioro de la exhalación, y el riesgo de barotrauma. La decisión de intubar a un paciente para evitar la hipoxia severa debe hacerse con mucho cuidado, ya que la estimulación traqueal puede empeorar la exacerbación del asma y empeora con frecuencia la obstrucción de la vía aérea e hipercapnia.
SEDACIÓN Y PARÁLISIS NEUROMUSCULAR
KETAMINA
De los agentes sedantes que están disponibles para facilitar la intubación, la ketamina se utiliza más comúnmente. La ketamina, un derivado sintético de la fenciclidina, se recomienda a menudo como el agente de inducción de elección para el paciente con asma que requieren intubación porque tiene acción borncodilatadora, así como efectos sedantes. La ketamina también se ha administrado en infusión continua en pacientes que reciben ventilación con presión positiva invasiva o no invasiva (VNIPP) para el asma. Cuando se utiliza de esta manera, una dosis de carga de 2 mg/kg es seguida por una infusión de 20 a 60 microgramos/kg/min.
PROPOFOL
El propofol es otro agente que se utiliza para facilitar la intubación en niños. Es un potente hipnótico/anestésico que realiza depresión del sistema nervioso central a través de la activación del ácido gamma-aminobutírico (GABA). EL propofol disminuye la tasa metabólica cerebral de consumo de oxígeno y reduce la presión intracraneal. Además, se ha informado que tienen propiedades antiinflamatorias y para dilatar las vías respiratorias centrales. Por esta razón, se utiliza comúnmente para facilitar la intubación en pacientes con estado asmático . Hay informes documentados de la broncoconstricción inducida por propofol en algunos pacientes con atopia y asma inducida por drogas, pero la broncodilatación en otros.
A diferencia de la ketamina , para los que no existe una prohibición contra el uso prolongado en la unidad de cuidados intensivos pediátricos (UCIP), el uso prolongado de propofol se asocia con el síndrome de la infusión de propofol que incluye cardíaca e insuficiencia renal, rabdomiolisis, hepatomegalia, hiperpotasemia, hipertrigliceridemia, y acidosis metabólica. Se produce con mayor frecuencia en niños y en pacientes críticamente enfermos tratados con glucocorticoides y catecolaminas, la Food and Drug Administration (FDA) ha prohibido su uso para la sedación en la UCIP.
OTROS SEDANTES
EL fentanilo y el midazolam se utilizan en combinación comúnmente en el marco UCIP para lograr la sedación, la dexmedetomidina, un agonista alfa-2-selectivo del receptor, está aprobado para su uso en hasta 24 horas en la población adulta. Hay múltiples informes de su seguridad y eficacia en la población pediátrica. La dosificación se extrapola en gran parte de la literatura para adultos. Los pacientes típicamente se cargan con 1 mcg/kg durante 10 a 20 minutos, pero algunos centros pediátricos reducen o eliminan la dosis de carga en un esfuerzo para evitar la hipotensión y bradicardia, los dos efectos adversos más comúnmente encontrados en la población pediátrica. La literatura disponible propugna un rango de dosis de infusión 0,2-0,7 mcg/kg/h, pero la literatura pediátrica sugiere dosis tan altas como 2 mcg/kg/h se puede utilizar de forma segura. Además de sedación para el paciente ventilado, la dexmedetomidina también se utiliza para facilitar la tolerancia de la VNI.
BLOQUEO NEUROMUSCULAR
El bloqueo neuromuscular se puede emplear como un complemento a la intubación y para disminuir la taquipnea y la asincronía con el ventilador en pacientes sedados que reciben ventilación asistida. Sin embargo, se deben hacer esfuerzos para suspender el uso de agentes bloqueadores neuromusculares, tan pronto como sea posible ya que su uso en combinación con glucocorticoides se asocia con un mayor riesgo de miopatía del enfermo crítico. Rocuronio
INTUBACIÓN ENDOTRAQUEAL Y VENTILACIÓN MECANICA
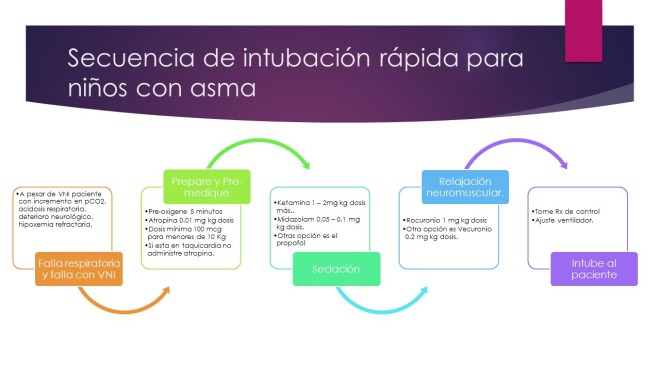
La intubación debe abordarse con precaución en pacientes con estado asmático, ya que la manipulación de la vía aérea puede causar un aumento de la obstrucción del flujo de aire debido a la reactividad bronquial exagerada. Un adecuado acceso venoso, control de la presión arterial no invasiva frecuente, y sedación deben optimizarse antes de la intubación. El médico más experimentado con la gestión de la vía aérea debe realizar la intubación.
Los médicos deben estar preparados para manejar el deterioro agudo debido a la mala posición del tubo, obstrucción del tubo, neumotórax, fallas en los equipos, e/o hipotensión.
Indicaciones: la decisión de intubar a un paciente con estado asmático se realiza con base en los hallazgos clínicos (por ejemplo, incapacidad para hablar, confusión o somnolencia, hipoxia a pesar de oxígeno suplementario) y los cambios fisiológicos (por ejemplo, hipercapnia moderada a severa).
INDICACIONES DE INTUBACIÓN EN ASMA
- Hipoxemia a pesar de prestación de altas concentraciones de oxígeno o ventilación no invasiva con presión positiva (VNIPP) (presión parcial de oxígeno [pO 2 ] <60 con FiO2 al 100 por ciento de oxígeno o VNIPP)
- Aumento severo del trabajo respiratorio.
- Estado mental alterado
- Paro respiratorio o paro cardíaco
EL hallazgo de Hipercapnia no es una indicación de intubación. Sin embargo, la intubación se justifica si un paciente presenta una progresiva elevación de la presión parcial arterial de dióxido de carbono (PaCO2) a pesar del tratamiento médico máximo y el uso de VNI, y si la hipercapnia está causando acidosis respiratoria grave o alteración del estado mental.
OBJETIVOS DE LA INTUBACIÓN Y VENTILACIÓN MECÁNICA
Los objetivos de la intubación endotraqueal y la ventilación mecánica para los niños con estado asmático e insuficiencia respiratoria son:
- Disminuir el trabajo respiratorio
- Asegurar oxigenación adecuada.
- Asegurar suficiente, aunque todavía anormal, intercambio de gases.
Estos objetivos deben llevarse a cabo con los efectos adversos menor cantidad. El paciente debe recibir respiraciones con una bolsa y manómetro en línea antes de iniciar la ventilación mecánica.
OXIGENACIÓN
Una adecuada oxigenación se consigue normalmente sin dificultad en la mayoría de los pacientes con asma, ya que las vías respiratorias, no los alvéolos, son los objetivos principales de la inflamación y broncoespasmo. Sin embargo, el taponamiento mucoso, atelectasia, la hiperinflación, y el desajuste de la ventilación/perfusión (V/Q) pueden contribuir a la hipoxemia. La oxigenación se ve afectada principalmente por la fracción de oxígeno inspirado (FiO2).
La atelectasia que resulta del taponamiento mucoso generalmente se puede tratar con la aplicación juiciosa de PEEP, así como la eliminación regular de las secreciones de la sonda endotraqueal. El drenaje postural también ayuda a eliminar la atelectasia.
Si estas medidas resultan insuficientes, se pueden dejar una PEEP extrínseca de 3 – 5 cm H2O. La titulación de PEEP también puede ser útil en el reclutamiento de unidades pulmonares atelectásicas. La hiperinflación, sin embargo, mediante la generación de más zona I de West, puede producir alteraciones de ventilación/perfusión más graves y conducir a mayor hipoxemia.
ESTRATEGIAS DE VENTILACIÓN
La ventilación mecánica con éxito en pacientes con asma depende de limitar el riesgo de hiperinflación y barotrauma. El riesgo de hiperinflación se reduce al disminuir el volumen minuto y permitiendo suficiente tiempo para la exhalación completa antes de que se inicie la siguiente inhalación. Esto se logra reduciendo la frecuencia respiratoria y aumentando el tiempo espiratorio mientras se mantiene un tiempo inspiratorio normal, disminuyendo de ese modo la relación de inspiración a espiración (relación I: E). El riesgo de barotrauma se reduce al minimizar la hiperinflación y la presión inspiratoria pico (PIP). Por estas razones, muchos consideran que la ventilación con presión de soporte (PSV) sería el modo ideal de ventilación para el paciente intubado con asma, pero no hay evidencia para apoyar un modo de ventilación sobre otro.
HIPERCAPNIA PERMISIVA
Para disminuir el riesgo de hiperinflación y barotrauma se requiere la aceptación de una PaCO2 inicial más alta de lo normal con una acidosis respiratoria acompañante, una estrategia que se denomina «hipercapnia permisiva» o «hipoventilación controlada». Un lento aumento en PaC02 (aproximadamente 10mmHg/h) permite mecanismos de amortiguación intracelulares para adaptarse al pH sérico bajo. La hipercapnia permisiva es bien tolerado por los niños con la función cardiaca normal. Sin embargo, aquellos con enfermedades crónicas concurrentes, tales como la cardiopatía congénita cianógena, cardiomiopatía, o hipertensión pulmonar probablemente no toleren esta estrategia. Otras contraindicaciones potenciales para la ventilación hipercápnica permisiva incluyen el aumento de la presión intracraneal, la mala función miocárdica y acidosis metabólica coexistente (por ejemplo, los pacientes con enfermedad renal).
MODO VOLUMEN CONTROL
En la ventilación de volumen control (PRVC o SIMV/VC), la inspiración se termina después de la entrega de un volumen preestablecido. Una ventaja de la ventilación de control de volumen es que permite la comparación de la presión PIP y meseta, que proporciona una indicación de la resistencia de la vía aérea y la respuesta al tratamiento. Una desventaja es que las presiones de pico pueden ser elevadas, dependiendo de la resistencia de las vías respiratorias, taponamiento mucoso, y el grado de atelectasia. Sin embargo, puede ser necesario la transición a PRVC si el PIP y/o la Pplat elevan por encima de 35 cm o 30H2O, respectivamente, con la salvedad de que el uso del bloqueo neuromuscular debe mantenerse a un mínimo, en un esfuerzo para evitar miopatía de enfermedad crítica.
VOLUMEN CONTROL REGULADO POR PRESIÓN.
El PRVC es un modo específico para el Servo 300 y ventiladores Servo I (este último tiene SIMV/PRVC) que asegura que el paciente recibe el conjunto deseado de volumen, pero en el pico de presión más bajo posible. PRVC ofrece ventajas que incluyen flujo inspiratorio óptimo de desaceleración, volumen tidal asegurado y presiones de la vía aérea minimizadas.
CONTROL PRESIÓN
En la ventilación de control de presión (SIMV/PC), la inspiración cesa cuando se alcanza una presión máxima preestablecida. El volumen entregado varía dependiendo de la mecánica pulmonar (por ejemplo, la resistencia de las vías respiratorias, la compliance pulmonar y la hiperinflación), y la ventilación minuto no está asegurado.
SIMV
En SIMV, el ventilador suministra respiraciones basadas en un volumen corriente o pico de presión y una frecuencia respiratoria preestablecida que se sincronizan con el esfuerzo inspiratorio del paciente. Sin embargo, si el paciente no inicia una respiración, una respiración con el volumen corriente completo será entregado en el intervalo apropiado (es decir, una respiración cada cinco segundos si el la frecuencia respiratoria se fija en 12 respiraciones por minuto). SIMV se puede entregar con control de volumen (SIMV / VC) o control de presión (SIMV / PC).
CONFIGURACIÓN DEL VENTILADOR.
La elección de los parámetros del ventilador mecánico debe tener en cuenta las alteraciones fisiológicas del asma aguda grave, incluyendo obstrucción del flujo aéreo y atelectasia, así como los objetivos de minimizar la hiperinflación y barotrauma.
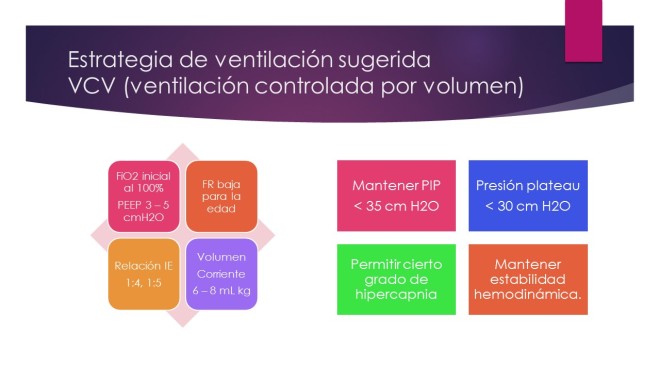
FiO2: la fracción de oxígeno inspirado (FiO2) debe fijarse en 1,0 posterior a la intubación. FiO2 es entonces disminuida según la tolerancia a concentraciones de 0,5 o menos para mantener la saturación de oxígeno> 92 por ciento. El uso de una FiO2 de 1,0 por períodos prolongados en pacientes con asma les predispone a atelectasia por reabsorción y por lo tanto debe evitarse.
Frecuencia respiratoria: la frecuencia respiratoria debe establecerse cerca o debajo de la frecuencia normal para la edad del paciente pediátrico, manteniendo la ventilación minuto en 115 ml/kg por minuto.
Volumen corriente: el volumen corriente debe ser el necesario y tratar de que la PIP < 35 cm H2O y al Pplat <30 cm H2O. Habitualmente iniciar con 6 – 8 mL kg.
Tiempos de inspiración y espiración y de flujo inspiratorio: los tiempos inspiratorios deben ser normales a ligeramente bajos para la edad del paciente y la frecuencia respiratoria lo suficientemente baja para que el tiempo espiratorio evite el auto PEEP. Las relaciones recomendadas son: 1:4 o 1:5.
El tiempo espiratorio debe maximizarse para permitir la exhalación completa, evitar la hipercapnia, y evitar la hiperinflación dinámica y PEEP intrínseco (elevación de la presión alveolar encima de la presión atmosférica al final de la exhalación, también llamado auto-PEEP).
Con este fin, el flujo inspiratorio debe fijarse en la tasa más alta el paciente puede tolerar sin generar presiones excesivamente altas. Las velocidades de flujo de 4 a 10 L/kg por minuto, con un máximo de 80 a 100 L/minuto, se emplean típicamente en niños durante PCV.
PEEP: algún grado de PEEP extrínseca es necesario para compensar la resistencia externa añadido al tracto respiratorio por el tubo endotraqueal (por ejemplo, PEEP de 3 a 5 cm H 2 0). El uso de PEEP extrínseca más allá de esta cantidad en el paciente ventilado con asma es considerado controversial por algunos. Sin embargo, otros expertos consideran que la PEEP es una intervención útil con las debidas precauciones, especialmente en pacientes con atelectasia, ya PEEP efectivamente pueden abrir las vías colapsado, mejorará la ventilación y reducirá potencialmente el atrapamiento de aire. Los niveles más altos de PEEP (5 a 8 cm H 2 0) pueden ser beneficiosos para los niños que demuestran hipercapnia persistente y severa a pesar de un volumen corriente apropiado (de 6 a 10 ml/kg) y los tiempos espiratorios que permitan la exhalación completa.
COMPLICACIONES
Las complicaciones pueden resultar de la exacerbación del asma en sí o los tratamientos. Los pacientes con una exacerbación del asma severa aguda están en riesgo de atrapamiento progresivo y de hiperinflación alveolar, lo que puede conducir a la ruptura alveolar y compromiso hemodinámico. La intubación endotraqueal con ventilación mecánica en el niño con asma puede estar asociada con una morbilidad significativa, incluyendo hipotensión, barotrauma (incluyendo neumotórax), y miopatía.
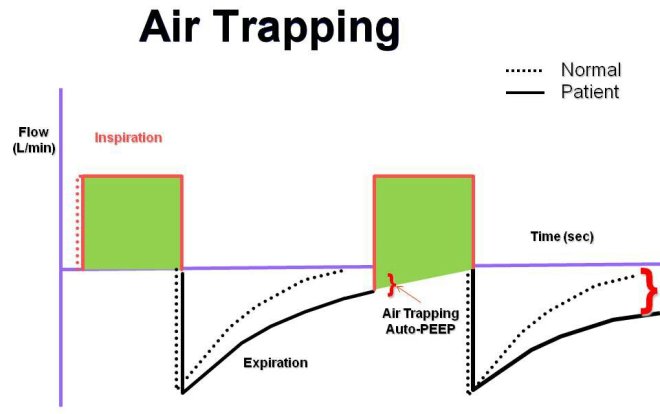
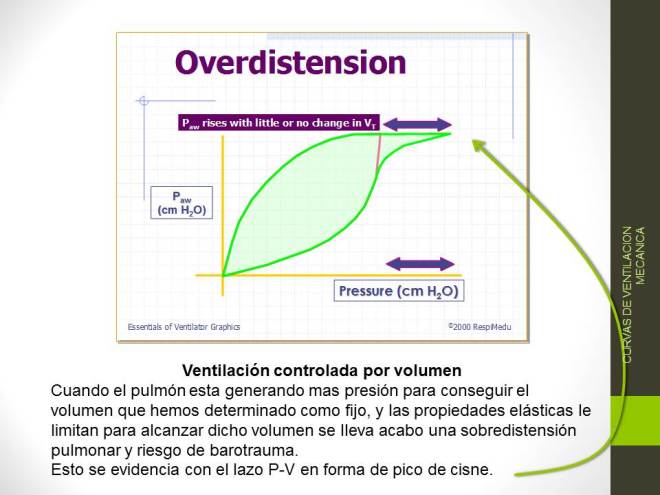
HIPERINFLACIÓN DINÁMICA
La obstrucción del flujo de aire durante la espiración retrasa el vaciado de pulmón, en parte porque el aumento de volumen pulmonar tiende a aumentar el calibre de la vía aérea y puede reducir el trabajo resistivo de la respiración. Esto puede conducir a la iniciación de inspiración antes de la exhalación es completa.
En esta gráfica se evidencia el fenómeno de atrapamiento aéreo debido a un tiempo espiratorio inadecuado.
El fenómeno que se produce cuando un nuevo aliento comienza antes de que el pulmón se ha alcanzado el volumen de equilibrio estático se llama hiperinflación dinámica. La hiperinflación dinámica aumenta la magnitud de la caída en la presión de la vía aérea que el paciente debe generar para desencadenar una respiración, lo que aumenta la carga de trabajo del paciente. Esta respuesta fisiológica se vuelve mala adaptación en pacientes con asma grave, que se produce a expensas de una mayor carga mecánica y del trabajo elástico de respiración. Hiperinflación dinámica puede causar sobredistensión alveolar que resulta en hipoxemia, hipotensión, o una ruptura alveolar. La hiperinflación dinámica puede ocurrir en pacientes con asma que están respirando espontáneamente, pero es más común, y potencialmente más difícil de manejar, en pacientes ventilados debido al uso de presión positiva.
Las intervenciones para corregir atrapamiento aéreo incluyen la disminución de la frecuencia respiratoria, el aumento de las tasas de flujo inspiratorio, y la reducción del volumen corriente. Mantener el volumen minuto < 115 mL kg es una meta adecuada para evitar la hiperinflación dinámica.
BAROTRAUMA
El barotrauma pulmonar en el paciente con ventilación mecánica es el resultado de una ruptura alveolar y se caracteriza por el desarrollo de aire extraalveolar. El barotrauma se produce cuando la presión transalveolar aumenta en un grado que altera la integridad estructural de los alvéolos. Esto lleva a una ruptura alveolar y el enfisema intersticial. El resultado es neumotórax si el enfisema intersticial disecciona junto las vainas perivasculares en el mediastino y luego las ruptura de la pleura parietal del mediastino.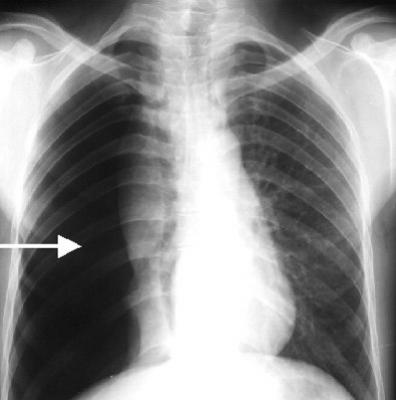
La disección de aire en otros lugares a lo largo de los planos fasciales puede resultar en neumomediastino, neumoperitoneo, o enfisema subcutáneo. Otras manifestaciones clínicas de barotrauma pulmonar incluyen fístula broncopleural, neumotórax a tensión, quistes pulmonares a tensión, hiperinflación del lóbulo inferior izquierdo, embolia sistémica de gas, y los quistes subpleurales de aire.
El neumotórax se debe sospechar si el paciente queda después de la intubación con hipoxemia e hipotensión y la hipoxemia e hipotensión no responden a la administración de líquidos y la alteración en el patrón ventilatorio. Una radiografía de tórax debe realizarse con prontitud para que el tratamiento se puede proporcionar con rapidez. El médico más experimentado debe realizar la descompresión con aguja o la inserción de un tubo torácico.
HIPOTENSIÓN ARTERIAL
La hipotensión es un riesgo en cualquier paciente que se pasó de respiración espontánea a ventilación con presión positiva. Este riesgo es mayor en pacientes con asma con asistencia respiratoria mecánica. La hiperinflación que es intrínseca al asma y el aumento de la presión intratorácica asociada a la ventilación de presión positiva impiden el retorno venoso al corazón. Este efecto puede verse agravada por la administración de sedantes y paralíticos, que actúan como vasodilatadores y depresores del miocardio.
Varios pasos se pueden tomar para minimizar el riesgo de hipotensión en pacientes con asma que requieren ventilación mecánica. Estos incluyen medidas para limitar la presión máxima y evitar la hiperinflación, como se describió anteriormente. Los pacientes también pueden beneficiarse de la administración de líquidos por vía intravenosa para mejorar y optimizar el volumen intravascular. Optimización de volumen intravascular puede ayudar a mitigar la taquicardia que resulta de la vasodilatación asociada con la absorción sistémica de los broncodilatadores.
Los médicos que atienden a los niños con crisis de asma aguda grave que requieren ventilación mecánica deben estar preparados para proporcionar un volumen de reanimación en caso de necesidad. Una medida extrema que se puede tomar si la presión arterial no responde a la reposición de volumen es desconectar transitoriamente el paciente del ventilador o resucitador manual (máscara de válvula de la bolsa o bolsa Ambu). Esto permite la evacuación completa del pulmón, y, a su vez, el llenado apropiado del corazón.
Bibliografía
- Newth CJ, Meert KL, Clark AE, et al. Fatal and near-fatal asthma in children: the critical care perspective. J Pediatr 2012; 161:214.
- Carroll CL, Smith SR, Collins MS, et al. Endotracheal intubation and pediatric status asthmaticus: site of original care affects treatment. Pediatr Crit Care Med 2007; 8:91.
- Bratton SL, Newth CJ, Zuppa AF, et al. Critical care for pediatric asthma: wide care variability and challenges for study. Pediatr Crit Care Med 2012; 13:407.
- Rotta AT. Asthma. In: Pediatric critical care, 4th ed, Fuhrman BP, Zimmerman JJ (Eds), Mosby, Philadelphia 2012.
- Hauser GJ, Bell KG. Prolonged propofol infusions in critically ill children: are we ready for a large controlled study? Pediatr Crit Care Med 2014; 15:176.
- Mannix R, Bachur R. Status asthmaticus in children. Curr Opin Pediatr 2007; 19:281
- Joy. D Howel. Acute severe asthma exacerbations in children: Endotracheal intubation and mechanical ventilation. Up to date. November 2014

Debe estar conectado para enviar un comentario.